Centro Studi di Fase 1
Il Centro per gli studi di Fase1-Early Phase (CSEP) degli IFO coniuga la ricerca sperimentale e clinica, da un lato, e la ricerca clinica e l’assistenza diretta al paziente, dall’altro. Un gruppo di esperti ha il compito di seguire le fasi di sviluppo dei farmaci in un continuum che parte dalla ricerca di laboratorio su modelli sperimentali in vitro ed in vivo e giunge al letto del paziente sotto forma di trials clinici ‘early phase’ (fasi 0, I e II). All’IFO si svolgono tutte le fasi del trial clinico (Clinical Trials Center)
da un lato, e la ricerca clinica e l’assistenza diretta al paziente, dall’altro. Un gruppo di esperti ha il compito di seguire le fasi di sviluppo dei farmaci in un continuum che parte dalla ricerca di laboratorio su modelli sperimentali in vitro ed in vivo e giunge al letto del paziente sotto forma di trials clinici ‘early phase’ (fasi 0, I e II). Negli ultimi anni le sperimentazioni di Fase I stanno acquisendo un’importanza crescente e fondamentale, dettata anche dalla spinta verso la personalizzazione delle cure.
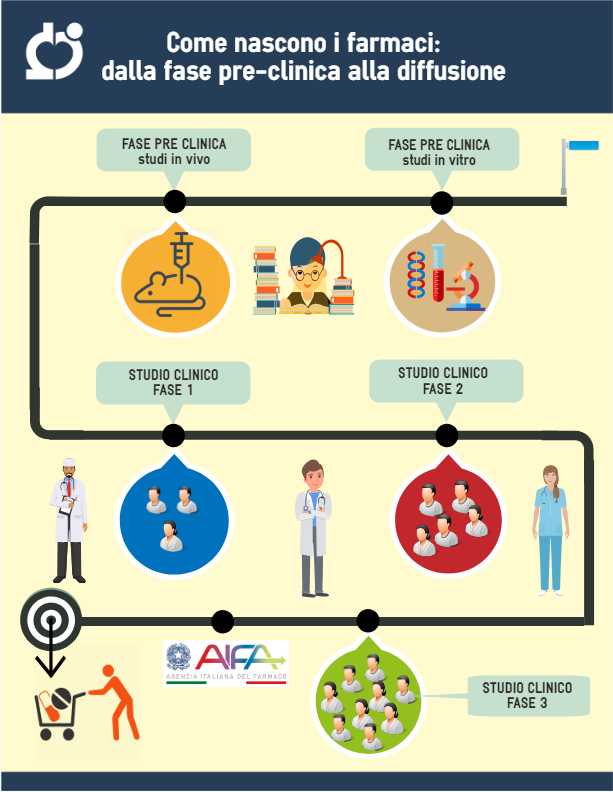 Gli studi clinici di fase 1 mirano a fornire una prima valutazione della sicurezza e tollerabilità del medicinale, sono condotti in pochi centri selezionati e oggi, rispetto al passato, coinvolgono un numero più grande di pazienti. Prevedono una fase denominata “dose escalation”, durante la quale sono testate dosi crescenti di farmaco fino a trovare la dose massima non tossica, e una fase di “espansione”, durante la quale tale dose massima non tossica viene testata su un numero sempre più ampio di pazienti. Possono essere coinvolti molti centri, a volte 50-60, e l’obiettivo è garantire che tutte le diverse realtà e tutti i partecipanti coinvolti nella sperimentazione: pazienti, medici, comitati etici, siano in grado di comunicare ed interagire tra loro, per valutare attentamente quanto sia sicuro il farmaco. Tutto ciò rende l’intera fase 1 molto complessa poiché non sono più una o due persone a gestire la sperimentazione ma gruppi multidisciplinari di individui. Se oggetto della sperimentazione sono gravi patologie, per esempio tumori, AIDS, eccetera, questi studi possono essere condotti direttamente su pazienti che ne sono affetti e per i quali il farmaco è stato pensato.
Gli studi clinici di fase 1 mirano a fornire una prima valutazione della sicurezza e tollerabilità del medicinale, sono condotti in pochi centri selezionati e oggi, rispetto al passato, coinvolgono un numero più grande di pazienti. Prevedono una fase denominata “dose escalation”, durante la quale sono testate dosi crescenti di farmaco fino a trovare la dose massima non tossica, e una fase di “espansione”, durante la quale tale dose massima non tossica viene testata su un numero sempre più ampio di pazienti. Possono essere coinvolti molti centri, a volte 50-60, e l’obiettivo è garantire che tutte le diverse realtà e tutti i partecipanti coinvolti nella sperimentazione: pazienti, medici, comitati etici, siano in grado di comunicare ed interagire tra loro, per valutare attentamente quanto sia sicuro il farmaco. Tutto ciò rende l’intera fase 1 molto complessa poiché non sono più una o due persone a gestire la sperimentazione ma gruppi multidisciplinari di individui. Se oggetto della sperimentazione sono gravi patologie, per esempio tumori, AIDS, eccetera, questi studi possono essere condotti direttamente su pazienti che ne sono affetti e per i quali il farmaco è stato pensato.
Gli studi attuali di fase 1, rispetto a quelli tradizionali, sono più mirati e coinvolgono persone secondo criteri precisi di arruolamento. Questo comporta che i pazienti vengano, soprattutto negli studi clinici oncologici, “screenati” e catalogati per genotipo specifico. Lo straordinario sviluppo delle tecnologie omiche (genomica, proteomica ecc.) sta avendo un impatto notevole nella pianificazione e nella conduzione degli studi clinici di medicina personalizzata e di precisione. Lo studio è spesso proposto solo ai pazienti per i quali si presume che il farmaco possa funzionare. In questo modo le probabilità per i pazienti di avere un beneficio aumentano.
Presso il centro per gli studi clinici di Fase1 IFO lavora un gruppo di esperti tra cui oncologi medici, farmacologo, infermieri di ricerca, data manager, quality manager, quality assurance, archvisti, responsabili gestione prodotto sperimentale, auditor , tutte figure di connessione tra la ricerca pre-clinica e quella clinica. In America li chiamano ‘physician scientists’ e sono impegnati a portare a compimento lo sviluppo di nuovi farmaci in un continuum che parte dalla ricerca di laboratorio e giunge al paziente attraverso i trials clinici ‘early phase’.
All’IFO inoltre la ricerca clinica rappresenta un punto nodale anche nello sviluppo della Medicina di Genere. Ciò può avere importanti ricadute sulla salute poiché sia il metabolismo dei farmaci che la loro detossificazione presentano rilevanti differenze uomo-donna. L’IFO è orientato a una rivalutazione dell’approccio medico-scientifico in un’ottica di genere ed è il primo IRCCS che ha istituito un gruppo di lavoro per promuovere e garantire attenzione alle variabili di genere.
In seguito all’entrata in vigore della determina AIFA n.809/2015, tutti i centri sperimentali e i laboratori che si occupano di studi di fase I hanno dovuto intraprendere il percorso di autocertificazione al fine di ottenere i requisiti. I centri devono soddisfare una serie di requisiti relativi alle strutture, apparecchiature, personale, gestione delle emergenze e soprattutto requisiti di qualità, che richiedono la messa a punto di un sistema di gestione della qualità e la scrittura di Procedure Operative Standard.
L’IFO è stato autorizzato ad operare dopo ispezione AIFA nel settembre 2018. E’ oggi attiva una convenzione con il Dipartimento di Medicina clinica e molecolare dell’Università di Roma La Sapienza per l’esecuzione di studi di interesse del dipartimento presso il centro di Fase 1 degli IFO.